Pregled
Brza identifikacija transgenih biljaka
Tekst/Tong Yucheng
Eksperimentalni rad/Han Ying
Urednik/Wen Youjun
Riječi/1600+
Preporučeno vrijeme čitanja/8-10 minuta
Brza identifikacija transgenih biljaka
Kao pridošlica u laboratoriju, nije dobar posao izdvajati pozitivne biljke iz gomile biljaka s niskom stopom konverzije.Najprije se DNK mora ekstrahirati iz velikog broja uzoraka jedan po jedan, a zatim će se PCR-om detektirati strani geni.Međutim, rezultati su često prazni i povremeno se nalaze trake s nekoliko stavki, ali je nemoguće utvrditi ima li propuštenih detekcija ili lažnih detekcija..Je li vrlo bespomoćno suočiti se s takvim eksperimentalnim procesom i rezultatima?Ne brini, brate te uči kako lako i točno izdvojiti transgene pozitivne biljke.
Korak 1: Primeri za otkrivanje dizajna
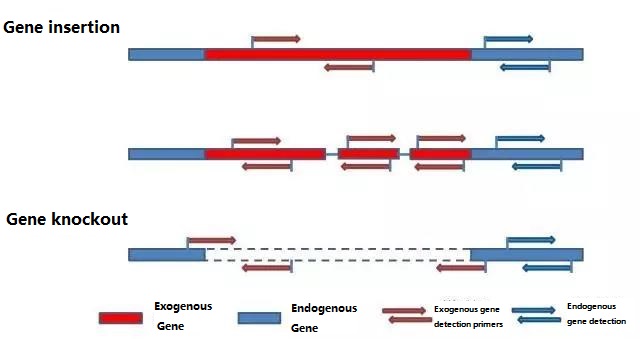
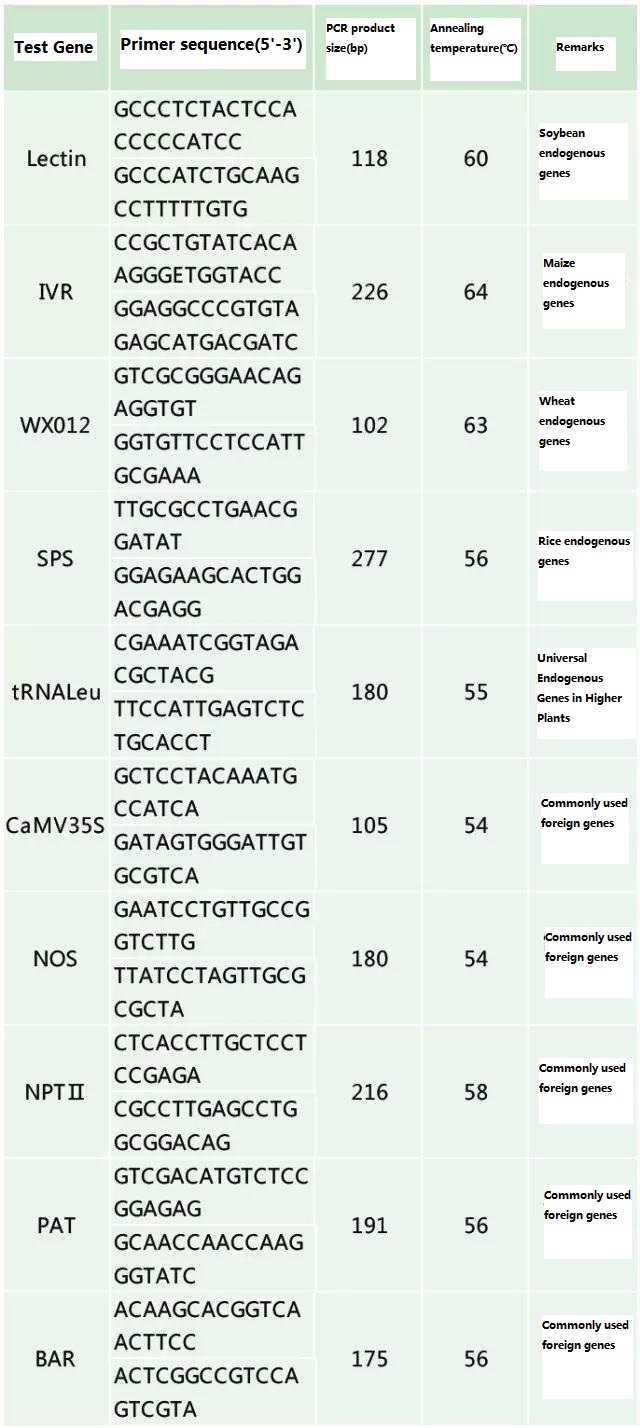
Odredite endogeni gen i egzogeni gen koji treba otkriti prema uzorku koji se testira i odaberite reprezentativnu sekvencu od 100-500 bp u genu za dizajn početnice.Dobri primeri mogu osigurati točnost rezultata detekcije i skratiti vrijeme detekcije (pogledajte dodatak za najčešće korištene primere detekcije).
Bilješka:
Novodizajnirani primeri trebaju optimizirati uvjete reakcije i provjeriti točnost, preciznost i granicu detekcije prije izvođenja detekcije velikih razmjera.
Korak 2:Razviti eksperimentalni protokol

Pozitivna kontrola: Upotrijebite pročišćenu DNK koja sadrži ciljni fragment kao predložak za određivanje jesu li PCR reakcijski sustav i uvjeti normalni.
Negativna/slijepa kontrola: Upotrijebite DNK šablonu ili ddH2O koji ne sadrži ciljni fragment kao predložak za otkrivanje postoji li izvor kontaminacije u PCR sustavu.
Unutarnja referentna kontrola: upotrijebite kombinaciju početnica/sonde endogenog gena uzorka koji se testira kako biste procijenili može li se uzorak detektirati PCR-om.
Bilješka:
Pozitivne, negativne/slijepe kontrole i interne kontrole treba postaviti za svaki test kako bi se procijenila valjanost eksperimentalnih rezultata.
3. korak: Priprema pokusa

Prije upotrebe provjerite je li otopina ravnomjerno izmiješana.Ako se nađe talog, potrebno ga je prije upotrebe otopiti i promiješati prema uputama.2×PCR mješavinu potrebno je pipetirati i više puta miješati mikropipetom prije upotrebe kako bi se izbjegla neravnomjerna raspodjela iona.
Bilješka:
Izvadite upute i pažljivo ih pročitajte, te se prije pokusa pripremite u skladu s uputama.
Korak 4: Pripremite PCR reakcijski sustav
Prema eksperimentalnom protokolu, pomiješajte početnice, H2O, 2×PCR pomiješajte, centrifugirajte i rasporedite u svaku reakcijsku epruvetu.
Bilješka:
Za opsežna ili dugotrajna testiranja preporučuje se korištenje PCR reakcijskog sustava koji sadrži enzim UNG, koji može učinkovito izbjeći kontaminaciju aerosolom uzrokovanu PCR proizvodima.
Korak 5: Dodajte predložak reakcije

Korištenjem Direct PCR tehnologije, nema potrebe za dosadnim procesom pročišćavanja nukleinske kiseline.Predložak uzorka može se pripremiti unutar 10 minuta i dodati u odgovarajući PCR reakcijski sustav.
Bilješka:
Metoda lize ima bolji učinak detekcije, a dobiveni proizvod se može koristiti za više reakcija detekcije.
5.1: Izravni PCR lišća
Prema veličini slike u priručniku, izrežite lisno tkivo promjera 2-3 mm i stavite ga u PCR reakcijski sustav.
Napomena: Provjerite jesu li dijelovi listova potpuno uronjeni u PCR reakcijsku otopinu i nemojte dodavati previše lisnog tkiva.
5.2: Metoda lize lista
Izrežite tkivo lista promjera 5-7 mm i stavite ga u epruvetu za centrifugiranje.Ako odaberete zrelo lišće, izbjegavajte korištenje tkiva glavne žile lista.Pipetirajte 50 ul pufera P1 lizata u epruvetu za centrifugu kako biste bili sigurni da lizat može potpuno uroniti tkivo lista, stavite ga u termalni cikler ili metalnu kupelj i lizirajte na 95°C 5-10 minuta.


Dodajte 50 ul otopine za neutralizaciju pufera P2 i dobro promiješajte.Dobiveni lizat može se koristiti kao predložak i dodati u PCR reakcijski sustav.
Napomena: Količina predloška treba biti između 5-10% PCR sustava i ne smije prelaziti 20% (na primjer, u 20 μl PCR sustavu dodajte 1-2 μl pufera za lizu, ne više od 4 μl).
Korak 6: PCR reakcija

Nakon centrifugiranja PCR reakcijske epruvete, stavite ih u PCR instrument za pojačavanje.
Bilješka:
Reakcija koristi nepročišćeni šablon za amplificiranje, tako da je broj ciklusa amplifikacije 5-10 ciklusa više nego kada se koristi pročišćeni DNA šablon.
Korak 7: detekcija elektroforeze i analiza rezultata

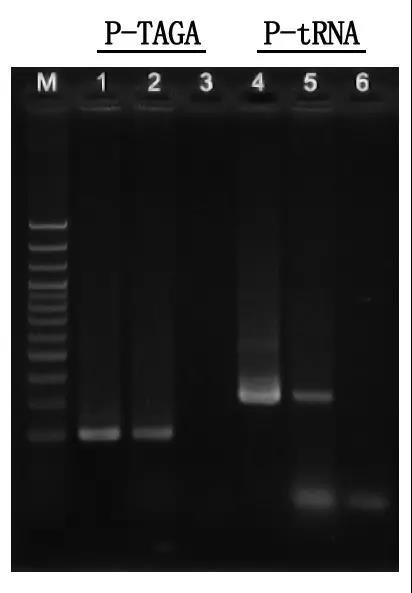
M:100bp DNK ljestve
1\4: Metoda pročišćene DNA
2\5: Izravna PCR metoda
3\6: Prazna kontrola
Kontrola kvalitete:
Rezultati ispitivanja različitih kontrola postavljenih u eksperimentu trebaju ispunjavati sljedeće uvjete.U suprotnom, potrebno je analizirati uzrok problema i ponoviti test nakon otklanjanja problema.
Tablica 1. Normalni rezultati ispitivanja različitih kontrolnih skupina

*Kada se plazmid koristi kao pozitivna kontrola, rezultat testa endogenog gena može biti negativan
Procjena rezultata:
A. Rezultat testa endogenog gena uzorka je negativan, što ukazuje da se DNA prikladna za običnu PCR detekciju ne može ekstrahirati iz uzorka ili ekstrahirana DNA sadrži inhibitore PCR reakcije, te DNA treba ponovno ekstrahirati.
B. Rezultat testa endogenog gena uzorka je pozitivan, a rezultat testa egzogenog gena je negativan, što ukazuje da je iz uzorka ekstrahirana DNK prikladna za običnu PCR detekciju, te se može procijeniti da gen XXX nije detektiran u uzorku.
C. Rezultat testa endogenog gena uzorka je pozitivan, a rezultat testa egzogenog gena je pozitivan, što znači da je iz uzorka ekstrahirana DNK prikladna za običnu PCR detekciju, a DNK uzorka sadrži XXX gen.Eksperimenti potvrde mogu se dalje provoditi.
Korak 8: Primeri za otkrivanje dizajna

Nakon eksperimenta, upotrijebite 2% otopinu natrijeva hipoklorita i 70% otopinu etanola za brisanje eksperimentalnog područja kako biste spriječili onečišćenje okoliša.
dodatak
Tablica 2. Često korišteni primeri za opću PCR detekciju genetski modificiranih biljaka
Referentni dokument:
SN/T 1202-2010, Kvalitativna PCR metoda detekcije genetski modificiranih biljnih sastojaka u hrani.
Priopćenje Ministarstva poljoprivrede 1485-5-2010, Ispitivanje sastojaka genetski modificiranih biljaka i njihovih proizvoda-riža M12 i njezini derivati.
Vrijeme objave: 9. lipnja 2021








